FORMULES CHIMIQUES : Différence entre versions
| Ligne 3 : | Ligne 3 : | ||
=====Atomes, ions et éléments===== | =====Atomes, ions et éléments===== | ||
| + | |||
| + | La découverte de l'atome est due à des philosophes tels que Leucippe et Démocrite, qui, pour tenter de répondre aux questions concernant le début et la fin du cosmos, l'unité et la diversité des êtres matériels, ont trouvé un dénominateur commun pour tous les êtres, pour tout l'univers : l'atome. Au fil des années et des siècles, cette volonté de comprendre l'origine du monde a contribué à considérer l'atome comme un objet physique par les physiciens. Cette unité de matière, aussi petite qu'elle soit, a permis de faire un grand pas dans la compréhension de notre univers et est encore au centre de nombreuses recherches.</br> | ||
| + | </br> | ||
*<b>les atomes</b> dont on connait 117 éléments actuellement (du 1 au 118, à l'exception du 117) dont 92 existent à l'état naturel sur Terre (<font color="#0000FF">Voir la liste à</font>[[Liste alphabétique des éléments naturels]]). Si d'aventure un électron est arraché à l'atome, il y a une charge '''+e''' excédentaire, on a ce que l'on appelle un «ion positif» ou «cation».Si par contre l'atome capture un électron qui passait par là, il y a une charge '''-e''' excédentaire, on a ce que l'on appelle un «ion négatif» ou «anion». Mais le noyau est inchangé, on a toujours le même élément chimique avec le même numéro atomique.<br> | *<b>les atomes</b> dont on connait 117 éléments actuellement (du 1 au 118, à l'exception du 117) dont 92 existent à l'état naturel sur Terre (<font color="#0000FF">Voir la liste à</font>[[Liste alphabétique des éléments naturels]]). Si d'aventure un électron est arraché à l'atome, il y a une charge '''+e''' excédentaire, on a ce que l'on appelle un «ion positif» ou «cation».Si par contre l'atome capture un électron qui passait par là, il y a une charge '''-e''' excédentaire, on a ce que l'on appelle un «ion négatif» ou «anion». Mais le noyau est inchangé, on a toujours le même élément chimique avec le même numéro atomique.<br> | ||
*<b>Les ions</b> sont des atomes qui ont perdu ou gagné un ou plusieurs électrons ; il ne sont plus neutres électriquement. | *<b>Les ions</b> sont des atomes qui ont perdu ou gagné un ou plusieurs électrons ; il ne sont plus neutres électriquement. | ||
Version du 21 novembre 2009 à 08:43
Sommaire
Composition chimique
Les minéraux ont une composition chimique bien déterminée, exprimée par une formule chimique. Cette formule est idéalisée, c'est-à-dire qu'elle ne mentionne que les principaux composants du minéral. Les très petites inclusions ou impuretés naturelles, qui peuvent influencer la couleur ou même la faire changer, ne sont pas prises en compte.
Atomes, ions et éléments
La découverte de l'atome est due à des philosophes tels que Leucippe et Démocrite, qui, pour tenter de répondre aux questions concernant le début et la fin du cosmos, l'unité et la diversité des êtres matériels, ont trouvé un dénominateur commun pour tous les êtres, pour tout l'univers : l'atome. Au fil des années et des siècles, cette volonté de comprendre l'origine du monde a contribué à considérer l'atome comme un objet physique par les physiciens. Cette unité de matière, aussi petite qu'elle soit, a permis de faire un grand pas dans la compréhension de notre univers et est encore au centre de nombreuses recherches.
- les atomes dont on connait 117 éléments actuellement (du 1 au 118, à l'exception du 117) dont 92 existent à l'état naturel sur Terre (Voir la liste àListe alphabétique des éléments naturels). Si d'aventure un électron est arraché à l'atome, il y a une charge +e excédentaire, on a ce que l'on appelle un «ion positif» ou «cation».Si par contre l'atome capture un électron qui passait par là, il y a une charge -e excédentaire, on a ce que l'on appelle un «ion négatif» ou «anion». Mais le noyau est inchangé, on a toujours le même élément chimique avec le même numéro atomique.
- Les ions sont des atomes qui ont perdu ou gagné un ou plusieurs électrons ; il ne sont plus neutres électriquement.
- Les éléments sont groupés en : métaux, non-métaux, métalloïdes, lanthanides, actinides, halogènes, gaz nobles....
Chaque élément est désigné par un code d'une lettre capitale, ou de deux lettres dont la première est une capitale et la seconde une minuscule ; c'est le symbole chimique. Par exemple : l'hydrogène est désigné par H, le carbone par C, l'azote par N , l'oxygène par O, le sodium par Na ), le fer par Fe, le calcium par Ca ...
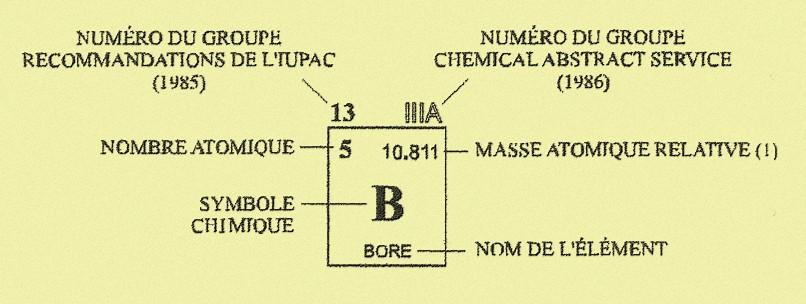
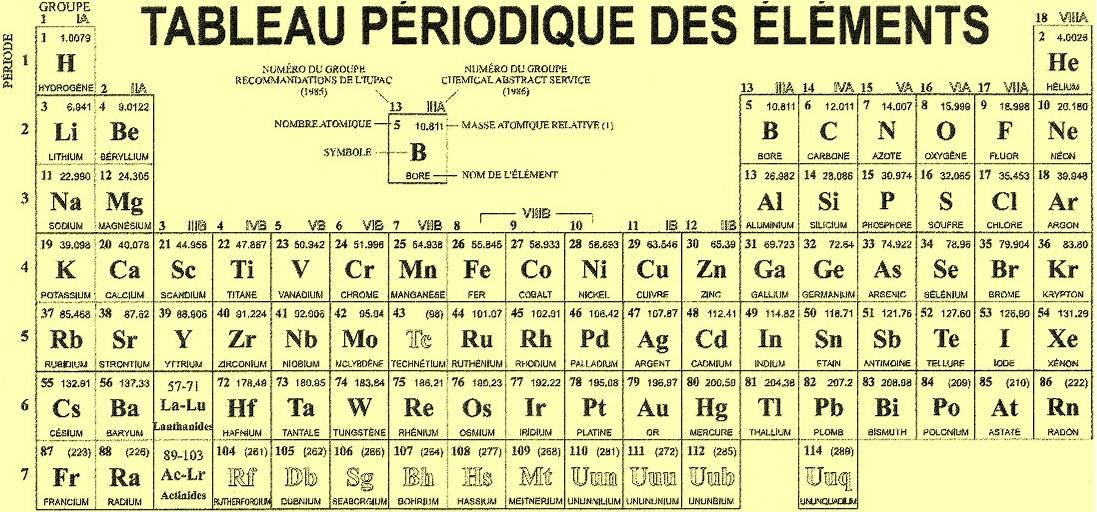
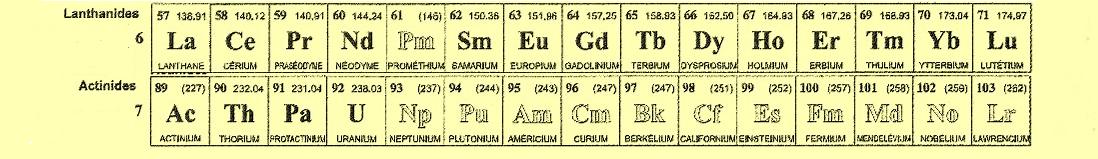
Voir un tableau plus récent à tableau périodique des éléments.
Liaison ionique
On sait que les objets ayant une charge opposée s'attirent, et que les objets ayant une charge de même signe se repoussent. Les + se repoussent entre eux, les - se repoussent entre eux, mais un + et un - s'attirent (force de Coulomb). Les ions se baladant dans la nature vont donc être attirés par des ions ayant une charge opposée, ils vont former un édifice électriquement neutre. Cette attraction électrostatique forme ce que l'on appelle la «liaison ionique». Elle est à l'origine de la cristallisation du sel.
Ainsi, les ions sodium Na+ et les ions chlore Cl- s'associent pour former le chlorure de sodium NaCl (édifice neutre), qui n'est autre que le sel de cuisine (halite). Les ions sont empilés en alternance, de sorte qu'un ion + n'est entouré que d'ions -, et un ion - n'est entouré que d'ions +.
Liaison moléculaire
Plutôt que de voler un électron à un autre atome comme dans le cas d'une réaction électrochimique, il peut y avoir une mise en commun d'un électron (chaque atome apporte un électron qu'il partage avec l'autre atome). C'est la liaison moléculaire ou liaison covalente.
- Les deux atomes peuvent être identiques, alors, on met un2 en indice du symbole chimique pour indiquer que la molécule contient deux atomes identiques : p.ex. les gaz dihydrogène (H2(), dioxygène (O2).
- Les atomes peuvent aussi être différents, on accole alors les deux symboles chimiques : p.ex. le monoxyde de carbone CO, le chlorure d'hydrogène HCl.
Un atome peut partager ses électrons avec plusieurs autres atomes, le carbone peut ainsi partager jusqu'à 4 électrons. Dans le cas de l'eau, l'atome d'oxygène partage deux électrons, un avec chaque atome d'hydrogène : H2O.
Formules chimiques
Les éléments se combinent pour faire tous les minéraux et roches trouvés dans la croûte terrestre. Les huit éléments principaux sont : oxygène O, silicium Si, aluminium Al, fer Fe, calcium Ca, sodium Na, potassium K, et magnésium Mg.
Le silicium Si combine avec deux atomes de l'oxygène O2 pour donner SiO2 pour faire le quartz, ou de la silice, et de là tous les minéraux silicatés (Voir aussi àSilicates).
Les mineraux peuvent être :
- un élément simple, comme le diamant, qui est fait de carbone, formule chimique : C
- des composés de deux éléments ou plus, comme le quartz, qui contient un silicium Si et deux atomes d'oxygène O2, formule chimique : SiO2.
Le point de départ est une analyse chimique.
La composition définie indique qu'une analyse chimique d'un minéral donné produira toujours le même taux des éléments. Par exemple, le quartz aura toujours un silicium Si pour chaque (groupe de) deux atomes d'oxygène O2. Par conséquent, les mineraux peuvent être exprimés par des formules chimiques, telles que SiO2 pour le quartz.
Dans certains minéraux, les éléments sont de taille et de charge semblable, ils se remplacent l'un l'autre. La quantité de fer et magnésium dans l'olivine change parce que ces éléments peuvent se remplacer l'un l'autre dans la structure du minéral. La formule de l’olivine, qui est un nom général pour un mélange (une solution solide) entre deux pôles principaux, la forstérite MgSiO4 et la fayalite FeSiO4, indique que pour chaque (groupe de) deux atomes de magnésium et/ou de fer, il y a un atome de silicium et quatre atomes d'oxygène.
Généralement, une formule d’olivine est écrite (Mg,Fe)2SiO4.
FORMULES CHIMIQUES des PRINCIPAUX MINERAUX
|
|
Voir aussi à Liste alphabétique des éléments naturels
| à voir aussi pour en apprendre plus sur les minéraux et les roches | ||
|
la détermination des minéraux | Classification Chimique des minéraux | silicates | Roche | ||
|
La cristallographie | systèmes cristallins | Cristal | Les macles | Troncatures
|